
Contente
- Função
- Estrutura
- A importância da catalase
- Fatores que afetam a efetividade da catalase
- Outros usos da catalase
A catalase é uma enzima encontrada nas células dos animais, plantas e bactérias aeróbicas. Uma enzima é uma molécula grande, sintetizada nas células e produzida para agir como um catalisador em uma reação. Cada tipo de enzima desempenha uma função específica, e a função da catalase é converter um subproduto potencialmente nocivo em elementos úteis para a célula.

Função
A catalase, como a maioria das enzimas, é uma proteína. Ela é encontrada nos peroxissomos, que são organelas celulares membranosas. A catalase tem uma função biológica importante: ela catalisa a quebra do peróxido de hidrogênio, uma substância tóxica para os organismos, em água e oxigênio molecular, que são ambos inofensivos e úteis.

Estrutura
A estrutura em forma de haltere da catalase contém quatro cadeias polipeptídicas, cada uma contendo mais de 500 aminoácidos. A catalase também apresenta quatro grupos heme, que são feitos de anéis de protoporfirina, contendo um único átomo de ferro. Estes anéis estão abrigados dentro das quatro cadeias.
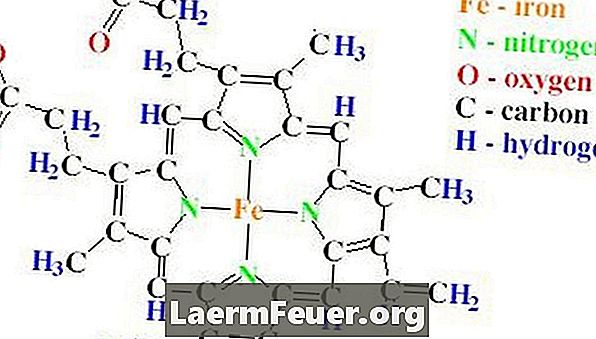
A importância da catalase
O peróxido de hidrogênio é um subproduto de muitas função biológicas dos organismos. Todos os organismos aeróbicos utilizam oxigênio na respiração. A redução do oxigênio em água é, muitas vezes, incompleta, e um elétron extra de um íon metálico pode ser transferido, causando a formação do peróxido. Entretanto, a maior parte do peróxido de hidrogênio é criada durante a produção de ATP, na mitocôndria. Apesar do peróxido de hidrogênio ser tóxico para células vivas, a reação pra quebrá-lo novamente em água e oxigênio ocorre rápida e efetivamente. A catalase é conhecida como uma das enzimas mais eficientes, apresentado um "turnover" próximo de 200.000 de eventos/segundo/subunidade. Sem a catalase para aumentar a taxa das reações, o peróxido de hidrogênio sobraria, danificando as células.
Fatores que afetam a efetividade da catalase
A catalase e sua taxa de atividade são alterados por vários fatores, incluindo temperatura, pH, concentração de sal, quantidade de substrato e a presença de inibidores ou ativadores. A temperatura é um importante fator em todas as reações bioquímicas, uma vez que a alta temperatura pode causar a desnaturação das enzimas. Quando a enzima desnatura, muda sua conformação, fazendo com que o substrato se ligue com menor eficiência, e portanto diminuindo a taxa de reação. Por outro lado, até que a temperatura máxima (que é diferente para cada tipo de catalase) seja alcançada, a taxa de reação irá aumentar juntamente com a temperatura. O pH, a medida da acidez ou da concentração de íons de hidrogênio em uma solução, é medido em uma escala de 0 a 14. Conforme a solução fica mais ácida (abaixo de 7), a enzima pode ganhar um íon de hidrogênio da solução, e conforme a solução se torna mais básica (acima de 7), ela pode perder um íon de hidrogênio. Qualquer um desses extremos pode reduzir a taxa de reação, uma vez que mudam as ligações químicas da catalase. Existem dois tipos de inibidores: inibidores não competitivos, que se ligam a um local que não é o sítio ativo, e inibidores competitivos, que se ligam ao sítio ativo da catalase. O sulfato de cobre é um conhecido inibidor não competitivo da catalase, e o cianeto é conhecido como um inibidor competitivo. Em geral, conforme a quantidade de peróxido de hidrogênio aumenta, a taxa de reação também irá aumentar. No entanto, as reações enzimáticas seguem a equação de Michaelis-Menten, que diz que toda reação irá atingir um ponto de saturação, significando que em uma taxa de reação máxima, a adição de mais substrato deixará de ter efeito.
Outros usos da catalase
Como a catalase está presente em praticamente todos os organismos vivos, ela é uma das enzimas mais estudadas. Isso levou os cientistas a encontrarem outras funções para esta eficiente enzima. A catalase é usada para tratar a parte de dentro dos plásticos para embalar alimentos. Ela previne a oxidação, e portanto, ajuda a conservar a comida. A catalase também é usada durante o processo de esterilização a frio, que é um processo para preservar o leite e queijo, através do tratamento com peróxido de hidrogênio. Essa enzima é usada para remover qualquer traço remanescente de peróxido de hidrogênio.